Intestino permeable o leaky gut: la barrera invisible que podría estar detrás de enfermedades crónicas y autoinmunes
La clave está en la ciencia, el cambio en ti
Imagina que las paredes de tu intestino fueran como un colador inteligente: lo suficientemente cerrado como para dejar pasar solo nutrientes útiles y agua, pero capaz de retener toxinas y microbios. Ahora imagina que ese colador empieza a tener orificios más grandes de lo normal. Eso, en esencia, es lo que ocurre en el llamado “síndrome de intestino permeable” o leaky gut, una condición que ha pasado de ser un concepto desconocido a un foco de interés para los tratamientos de las enfermedades actuales.
Definición
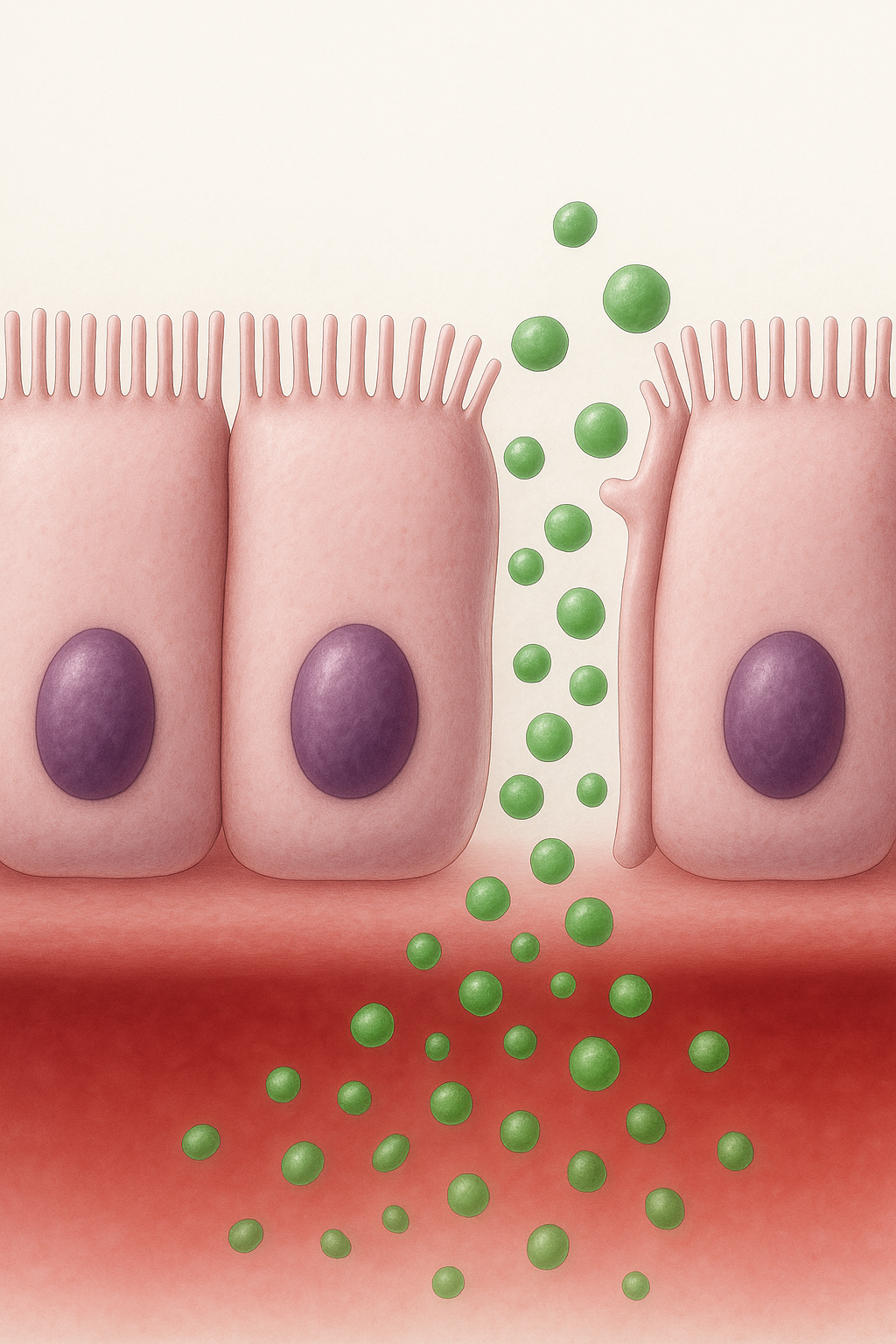
El síndrome de intestino permeable se refiere a un aumento anormal (patológico) del paso de macromoléculas a través de las uniones entre las células epiteliales del intestino, llamadas tight junctions (uniones estrechas). Estas estructuras regulan el paso selectivo de nutrientes y protegen contra el ingreso de toxinas, bacterias o algún agente dañino. Diversos estímulos como el gluten, infecciones o el estrés pueden activar la secreción de zonulina, una proteína que separa temporalmente las uniones estrechas (1). Este aumento de permeabilidad permite la translocación (traslado) de fragmentos o sustancias generadas por bacterias, como el lipopolisacárido (LPS), a la sangre,o generando inflamación (2,3)
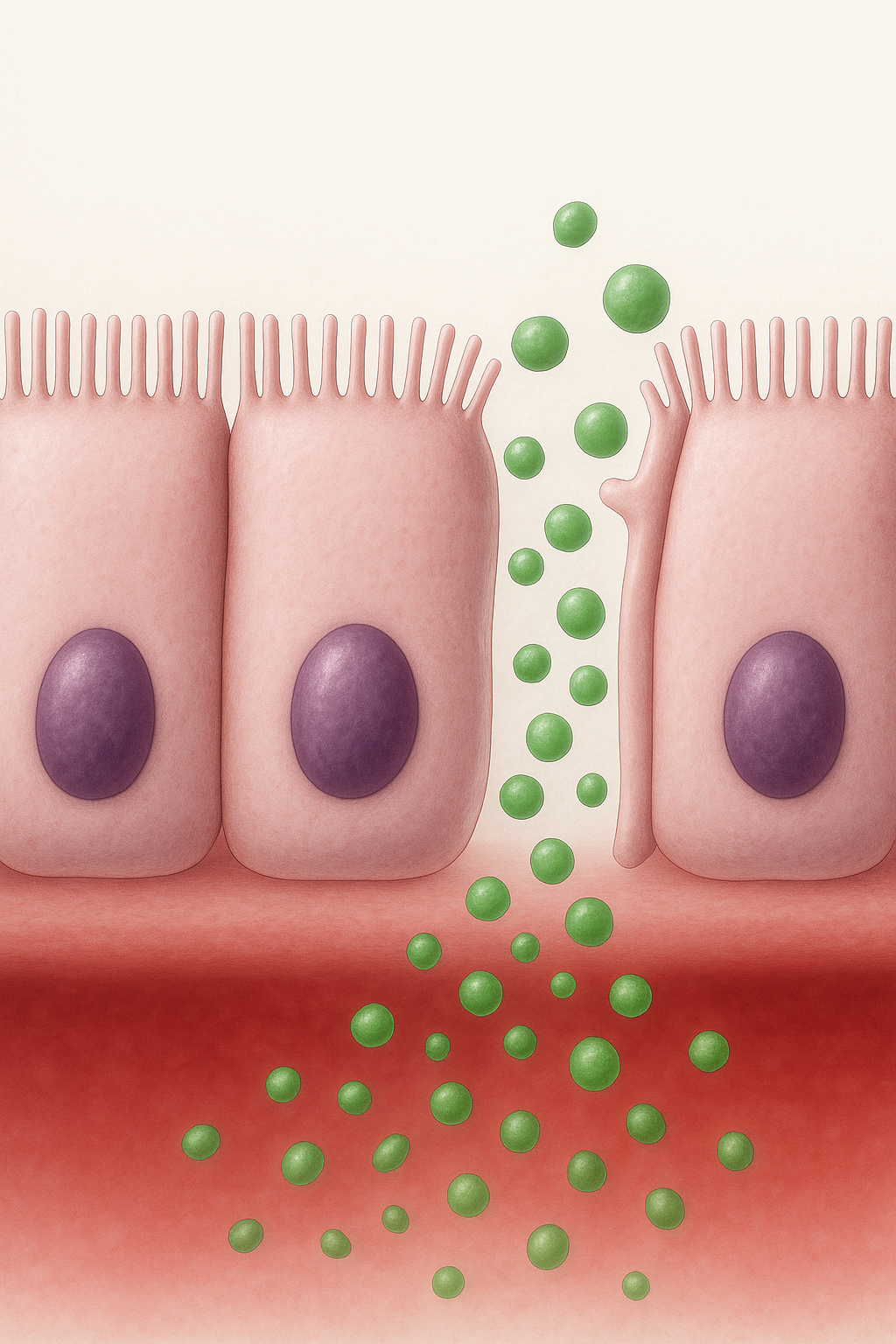
Tema relacionado específico: Leaky gut y sistema inmune
El intestino no es solo un órgano que te ayuda a digerir: es también es, por decirlo en simple, el centro de operaciones principal de tu sistema inmune en tu cuerpo. Cuando su barrera se ve comprometida, entran a la sangre sustancias que no deberían entrar (proteínas no digeridas, bacterias, compuestos generados por bacterias como LPS/lipopolasaaridos) generando señale sde alerta al sistema inmunitario provocando inflamación (que a su vez aumenta la permeabilidad) y pérdida de tolerancia inmunológica. Esto contribuye al desarrollo o exacerbación (agravar) de alergias o enfermedades autoinmunes como diabetes tipo 1, celiaquía, artritis reumatoide y esclerosis múltiple (4,5,47).
¿Cómo sospechar de una permeabilidad intestinal alterada?
Los síntomas asociados al “intestino permeable” son inespecíficos y fácilmente atribuibles a otras causas, lo que puede dificultar su identificación. Sin embargo, ciertos signos, cuando se presentan de forma persistente o se exacerban tras determinados estímulos (como consumo de gluten, alcohol, infecciones, estrés o antibióticos), pueden encender las alertas.
Algunos de estos síntomas incluyen:
-
Distensión abdominal y sensación de hinchazón recurrente
-
Gases excesivos, eructos o malestar digestivo postprandial
-
Cambios en el ritmo intestinal (diarrea, estreñimiento o ambos)
-
Brotes cutáneos como acné o dermatitis sin causa clara
-
Fatiga persistente no explicada por otras condiciones
-
“Niebla mental”, dificultades para concentrarse o sentirse “desconectado”
-
Dolor muscular o articular sin origen claro.
-
Cambios de humor, irritabilidad o ansiedad frecuentes
-
Intolerancia alimentaria reciente a múltiples alimentos

Estos síntomas no son diagnósticos por sí solos, pero adquieren valor clínico (valor a estudiar) si coinciden con eventos agravantes y antecedentes personales o familiares de enfermedades autoinmunes, alérgicas o inflamatorias.Para leer mas de inflamación, ve mi post (6)
¿Cómo se puede medir de forma más específica?
Para salir de la incertidumbre, existen exámenes que permiten evaluar directamente la integridad de la barrera intestinal como (7,8):
-
Test de lactulosa/manitol: mide la absorción diferencial de estas moléculas en orina, indicando una mala función de las tight junctions (uniones estrechas)
-
Zonulina en sangre o heces: esta proteína regula la apertura de las uniones estrechas. Niveles elevados se asocian con permeabilidad aumentada.(9)
-
LPS (lipopolisacáridos) en sangre: marcador indirecto de translocación bacteriana (Paso de bacterias del intestino a la sangre) desde el intestino.
-
Marcadores inflamatorios intestinales: como calprotectina fecal.
Estos exámenes ayudan a confirmar si los síntomas inespecíficos están relacionados con un daño real en la barrera intestinal, permitiendo un abordaje más preciso y personalizado.
Causas de la alteración de la permeabilidad intestinal
Las causas y consecuencias de la permeabilidad intestinal suelen ser bidireccionales, lo que en muchos lo vuelve un ciclo dificil de romper (3)
-
Genética: Polimorfismos en genes como HLA-DQ2.Son genes fuertemente asociados a la enfermedad celíaca(10). y esta patología se asocia a mayor riesgo de permeabilidad intestinal (11)
-
Disbiosis: Este sobretodo es causa y consecuencia Un desequilibrio de la microbiota, puede favorecer la colonización de bacterias malas (que aumenten inflamación) y la producción de metabolitos (LPS) que debilitan la barrera intestinal. (27,28). Recientemente hice un post de microbiota dónde puedes indagar más sobre la disbiosis (12). En simple se podría que si algo daña tu microbiota aumentará la permeabilidad
-
Estrés crónico: Mediante el eje hipotálamo-hipófisis-adrenal, el estrés aumenta cortisol y CRF, lo que debilita los tight junctions (13,14).
-
Alimentación de cafetería/ occidenteal: Dietas ricas en ultraprocesados, alcohol,(15) lactosa o gluten (16) (en predispuestos) favorecen la generación de zonulina.
-
Consumo de determinados “disparadores” a los que sensible: Alimentos a los que seas alérgico o tengas intolerancia a alguno de sus componentes.
-
Medicamentos o infecciones: Infecciones intestinales (parásitos/ bacterias o virus) o uso prolongado de AINEs también pueden dañar directamente la mucosa intestinal (17,18.39).
-
Ejercicio excesivo: Esto aplica particularmente en alto rendimiento (19)
-
Sedentarismo o baja masa muscular: Este es mas indirecto (20)
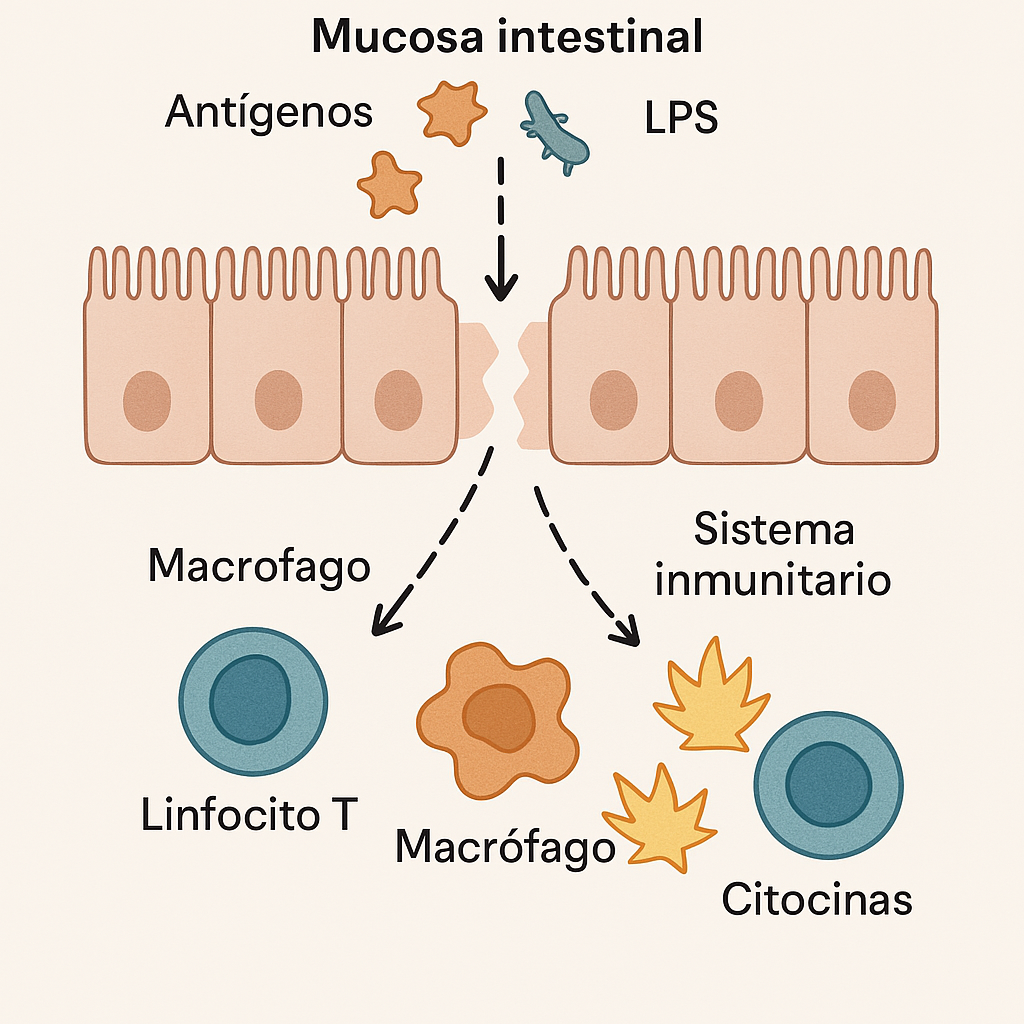
Consecuencias de la alteración de la barrera intestinal
-
Autoinmunidad: Permite el paso de antígenos que desencadenan respuestas aberrantes del sistema inmune (21). El desarrollo de autoinmunidad a pesar de estar relacionado a la permeabilidad no es tan simple como que haya permeabilidad, tiene que haber un agente intermedio. La autoinmunidad ocurre cuando tu propio sistema inmune ataca partes de tu cuerpo. En estos casos puede ocurrir que proteínas de algún alimento pasen a la sangre y que estas se parecen mucho a otras proteínas del cuerpo y el sistema inmune se confunde. (4,22)
-
Síndrome de colon irritable, alteraciones en el tránsito y mucosa intestinal (23,45,46)
-
Alergias alimentarias y atópicas: La mayor exposición a alérgenos favorece respuestas Th2 exacerbadas (24,25)
-
Acné:.Los granos en la piel suelen tener muchas causas, pero es muy común que ante la mala alimentación o alteración de la salud intestinal se generé acné (26)
-
Cáncer: El cáncer tiene muchas causas (me anotó post de cáncer en el futuro), siendo una gran raíz del problema la permeabilidad intestinal al ser promotor de la inflamación de bajo grado, daño a los tejidos del intestino u otros órganos. Cabe destacar que se asocia sobre todo a cánceres del sistema digestivo. De todas maneras cabe destacar que no son las únicas causas de cáncer importantes (ej: metales pesados, tabaco, radiación) (4,27,28).
-
Síndrome metabólico y obesidad: La obesidad genera aumento de LPS en el intestino y posterior paso a la sangre, junto a disbiosis intestinal. El ingreso de LPS bacteriano promueve inflamación de bajo grado (entiendase como "endotoxemia metabólica”)(5.29).
-
Enfermedades neurodegenerativas: Se ha observado disrupción de la barrera intestinal en Alzheimer y Parkinson (30,31,32,33). Los LPS tienen gran responsabilidad en esto.
-
Depresión: La depresión antiguamente se veía como una condición netamente neurológica, ahora se sabe que el eje intestino cerebro influye mucho en nuestro estado de ánimo(48)
-
TDAH, TEA, Bipolaridad: Si bien no se ha establecido que sea causal directa de estas condiciones se ha observado que al mejorar la permeabilidad y reducir en consecuencia los niveles de LPS e inflamación, pueden haber cambios en el comportamientos(34).
-
SIBO y disbiosis: Alteraciones de la microbiota generan un círculo vicioso que perpetúa la disfunción de barrera (35,44).
Medidas de acción para optimizar la permeabilidad intestinal
-
Uso de probióticos y prebióticos: Mejoran la composición de la microbiota y refuerzan las uniones intercelulares (36, 37). OJO CON HISTAMINA
-
Dieta enfocada en reparar la barrera intestinal y bajar la inflamación: Enfocada en alimentos integrales, rica en fibra, polifenoles y omega 3 (38) Evita alimentos irritantes, recupera salud hepática, infusiones (15).
-
Reducción del estrés: Técnicas como meditación o terapia cognitivo-conductual disminuyen la activación del eje HPA (14) .
-
Suplementación con glutamina y zinc: Nutrientes clave para la regeneración de las capas del intestino y de las uniones estrechas.(39,40,41,42 43).

Sugerencias finales
La salud de la barrera intestinal representa un componente central en el balance entre tu sistema inmune y tu intestino y como estos se relacionan con tu cuerpo Incorporar estrategias para fortalecer la barrera puede prevenir o mejorar el pronóstico de enfermedades crónicas. Es hora de que mires al intestino como un punto clave en la medicina personalizada y del estilo de vida.
Llamado a la acción: Nadie más que tu mismo sabe como responde tu cuerpo. Muchos alimentos pueden generarle problemas a alguien más y a ti no, y muchos alimentos o estilos de vida generan síntomas tan “sutiles” que los ignoramos. Es tu deber andar pendiente de tu propia salud.
Referencias
-
Sturgeon, C., & Fasano, A. (2016). Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers, 4(4), e1251384. https://doi.org/10.1080/21688370.2016.1251384
-
Meyer, F., Wendling, D., Demougeot, C., Prati, C., & Verhoeven, F. (2023). Cytokines and intestinal epithelial permeability: A systematic review. Autoimmunity Reviews, 22(6), 103331. https://doi.org/10.1016/j.autrev.2023.103331
-
Macura, B., Kiecka, A., & Szczepanik, M. (2024). Intestinal permeability disturbances: causes, diseases and therapy. Clinical and Experimental Medicine, 24(1), 232. https://doi.org/10.1007/s10238-024-01496-9
-
Fasano, A. (2011). Zonulin and its regulation of intestinal barrier function: The biological door to inflammation, autoimmunity, and cancer. Physiological Reviews, 91(1), 151-175. https://doi.org/10.1152/physrev.00003.2008
-
Mohammad, S., & Thiemermann, C. (2020). Role of metabolic endotoxemia in systemic inflammation and potential interventions. Frontiers in Immunology, 11, 594150. https://doi.org/10.3389/fimmu.2020.594150
-
Qué es la inflamación crónica de bajo grado, qué efectos genera en tu cuerpo y cómo puedes resolverlo. (s. f.). Nutricionistacientifico.cl. Recuperado 15 de abril de 2025, de https://nutricionistacientifico.cl/que-es-la-inflamacion/
-
Seethaler, B., Basrai, M., Neyrinck, A. M., Nazare, J.-A., Walter, J., Delzenne, N. M., & Bischoff, S. C. (2021). Biomarkers for assessment of intestinal permeability in clinical practice. American Journal of Physiology. Gastrointestinal and Liver Physiology, 321(1), G11-G17. https://doi.org/10.1152/ajpgi.00113.2021
-
Vanuytsel, T., Tack, J., & Farre, R. (2021). The role of intestinal permeability in gastrointestinal disorders and current methods of evaluation. Frontiers in Nutrition, 8, 717925. https://doi.org/10.3389/fnut.2021.717925
-
Fasano, A. (2020). All disease begins in the (leaky) gut: Role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Research, 9, 69. https://doi.org/10.12688/f1000research.20510.1.
-
Cecilio, L. A., & Bonatto, M. W. (2015). The prevalence of HLA DQ2 and DQ8 in patients with celiac disease, in family and in general population. Arquivos Brasileiros de Cirurgia Digestiva [Brazilian Archives of Digestive Surgery], 28(3), 183-185. https://doi.org/10.1590/S0102-67202015000300009
-
Cardoso-Silva, D., Delbue, D., Itzlinger, A., Moerkens, R., Withoff, S., Branchi, F., & Schumann, M. (2019). Intestinal barrier function in gluten-related disorders. Nutrients, 11(10), 2325. https://doi.org/10.3390/nu11102325
-
Microbiota: ¿Aliada o enemiga? Descubre qué dice sobre tu salud y cómo cuidarla con ciencia. (s. f.). Nutricionistacientifico.cl. Recuperado 15 de abril de 2025, de https://nutricionistacientifico.cl/microbiota-aliada-o-enemiga-descubre-que-dice-sobre-tu-salud-y-como-cuidarla-con-ciencia/
-
Leigh, S.-J., Uhlig, F., Wilmes, L., Sanchez-Diaz, P., Gheorghe, C. E., Goodson, M. S., Kelley-Loughnane, N., Hyland, N. P., Cryan, J. F., & Clarke, G. (2023). The impact of acute and chronic stress on gastrointestinal physiology and function: a microbiota-gut-brain axis perspective. The Journal of Physiology, 601(20), 4491-4538. https://doi.org/10.1113/JP281951
-
La Torre, D., Van Oudenhove, L., Vanuytsel, T., & Verbeke, K. (2023). Psychosocial stress-induced intestinal permeability in healthy humans: What is the evidence? Neurobiology of Stress, 27(100579), 100579. https://doi.org/10.1016/j.ynstr.2023.100579
-
Khoshbin, K., & Camilleri, M. (2020). Effects of dietary components on intestinal permeability in health and disease. American Journal of Physiology. Gastrointestinal and Liver Physiology, 319(5), G589-G608. https://doi.org/10.1152/ajpgi.00245.2020
-
Llanos-Chea, A., & Fasano, A. (2018). Gluten and functional abdominal pain disorders in children. Nutrients, 10(10), 1491. https://doi.org/10.3390/nu10101491
-
Bjarnason, I., Scarpignato, C., Holmgren, E., Olszewski, M., Rainsford, K. D., & Lanas, A. (2018). Mechanisms of damage to the gastrointestinal tract from nonsteroidal anti-inflammatory drugs. Gastroenterology, 154(3), 500-514. https://doi.org/10.1053/j.gastro.2017.10.049
-
Maseda, D., & Ricciotti, E. (2020). NSAID-gut Microbiota interactions. Frontiers in Pharmacology, 11, 1153. https://doi.org/10.3389/fphar.2020.01153
-
Clark, A., & Mach, N. (2016). Exercise-induced stress behavior, gut-microbiota-brain axis and diet: a systematic review for athletes. Journal of the International Society of Sports Nutrition, 13(1), 43. https://doi.org/10.1186/s12970-016-0155-6
-
Qaisar, R., Karim, A., Iqbal, M. S., Muhammad, T., Ahmad, F., & Alkahtani, S. A. (2024). The pathology of intestinal mucosal disruption; Implications for muscle loss and physical dependency from late adolescence to octogenarians. International Journal of General Medicine, 17, 6117-6126. https://doi.org/10.2147/IJGM.S501358
-
Kinashi, Y., & Hase, K. (2021). Partners in leaky gut syndrome: Intestinal dysbiosis and autoimmunity. Frontiers in Immunology, 12, 673708. https://doi.org/10.3389/fimmu.2021.673708
-
Cayres, L. C. d. F., de Salis, L. V. V., Rodrigues, G. S. P., Lengert, A. v. H., Biondi, A. P. C., Sargentini, L. D. B., Brisotti, J. L., Gomes, E., & de Oliveira, G. L. V. (2021). Detection of Alterations in the Gut Microbiota and Intestinal Permeability in Patients With Hashimoto Thyroiditis. Frontiers in Immunology, 12, 579140. https://doi.org/10.3389/fimmu.2021.579140.
-
Grover, M., Vanuytsel, T., & Chang, L. (2025). Intestinal permeability in disorders of gut-brain interaction: From bench to bedside. Gastroenterology, 168(3), 480-495. https://doi.org/10.1053/j.gastro.2024.08.033
-
Niewiem, M., & Grzybowska-Chlebowczyk, U. (2022). Intestinal barrier permeability in allergic diseases. Nutrients, 14(9), 1893. https://doi.org/10.3390/nu14091893
-
Aktas, O. N., Mateja, A., Li, M. (jenny), Chatman, L., Brittain, E., Baloh, C., Fulkerson, P., Wheatley, L., Togias, A., Lack, G., & Frischmeyer-Guerrerio, P. (2023). Evaluation of intestinal permeability in food allergy. The Journal of Allergy and Clinical Immunology, 151(2), AB324. https://doi.org/10.1016/j.jaci.2022.12.745
-
Gürel, R. C., Yıldırım, M., Erturan, İ., Korkmaz, S., & Doğuç, D. K. (2025). Measurement of acne severity, dietary habits, and blood zonulin levels in acne patients. Journal of Cosmetic Dermatology, 24, e70083. https://doi.org/10.1111/jocd.70083
-
Genua, F., Raghunathan, V., Jenab, M., Gallagher, W. M., & Hughes, D. J. (2021). The role of gut barrier dysfunction and microbiome dysbiosis in colorectal cancer development. Frontiers in Oncology, 11, 626349. https://doi.org/10.3389/fonc.2021.626349
-
Li, Q., von Ehrlich-Treuenstätt, V., Schardey, J., Wirth, U., Zimmermann, P., Andrassy, J., Bazhin, A. V., Werner, J., & Kühn, F. (2023). Gut Barrier dysfunction and bacterial Lipopolysaccharides in Colorectal Cancer. Journal of Gastrointestinal Surgery: Official Journal of the Society for Surgery of the Alimentary Tract, 27(7), 1466-1472. https://doi.org/10.1007/s11605-023-05654-4
-
Moreno-Navarrete, J. M., Sabater, M., Ortega, F., Ricart, W., & Fernández-Real, J. M. (2012). Circulating zonulin, a marker of intestinal permeability, is increased in association with obesity-associated insulin resistance. PloS One, 7(5), e37160. https://doi.org/10.1371/journal.pone.0037160
-
Sharma, S., Awasthi, A., & Singh, S. (2019). Altered gut microbiota and intestinal permeability in Parkinson’s disease: Pathological highlight to management. Neuroscience Letters, 712(134516), 134516. https://doi.org/10.1016/j.neulet.2019.134516
-
Houser, M. C., & Tansey, M. G. (2017). The gut-brain axis: is intestinal inflammation a silent driver of Parkinson’s disease pathogenesis? NPJ Parkinson’s Disease, 3(1), 3. https://doi.org/10.1038/s41531-016-0002-0
-
Kim, H. S., Kim, S., Shin, S. J., Park, Y. H., Nam, Y., Kim, C. W., Lee, K. W., Kim, S.-M., Jung, I. D., Yang, H. D., Park, Y.-M., & Moon, M. (2021). Gram-negative bacteria and their lipopolysaccharides in Alzheimer’s disease: pathologic roles and therapeutic implications. Translational Neurodegeneration, 10(1), 49. https://doi.org/10.1186/s40035-021-00273-y
-
Vogt, N. M., Kerby, R. L., Dill-McFarland, K. A., Harding, S. J., Merluzzi, A. P., Johnson, S. C., Carlsson, C. M., Asthana, S., Zetterberg, H., Blennow, K., Bendlin, B. B., & Rey, F. E. (2017). Gut microbiome alterations in Alzheimer’s disease. Scientific Reports, 7(1), 13537. https://doi.org/10.1038/s41598-017-13601-y
-
Asbjornsdottir, B., Snorradottir, H., Andresdottir, E., Fasano, A., Lauth, B., Gudmundsson, L. S., Gottfredsson, M., Halldorsson, T. I., & Birgisdottir, B. E. (2020). Zonulin-dependent intestinal permeability in children diagnosed with mental disorders: A systematic review and meta-analysis. Nutrients, 12(7), 1982. https://doi.org/10.3390/nu12071982
-
Park, J. H., Park, D. I., Kim, H. J., Cho, Y. K., Sohn, C. I., Jeon, W. K., Kim, B. I., Won, K. H., & Park, S. M. (2009). The relationship between small-intestinal bacterial overgrowth and intestinal permeability in patients with irritable bowel syndrome. Gut and Liver, 3(3), 174-179. https://doi.org/10.5009/gnl.2009.3.3.174
-
Zheng, Y., Zhang, Z., Tang, P., Wu, Y., Zhang, A., Li, D., Wang, C.-Z., Wan, J.-Y., Yao, H., & Yuan, C.-S. (2023). Probiotics fortify intestinal barrier function: A systematic review and meta-analysis of randomized trials. Frontiers in Immunology, 14, 1143548. https://doi.org/10.3389/fimmu.2023.1143548
-
Ramezani Ahmadi, A., Sadeghian, M., Alipour, M., Ahmadi Taheri, S., Rahmani, S., & Abbasnezhad, A. (2020). The effects of probiotic/synbiotic on serum level of zonulin as a biomarker of intestinal permeability: A systematic review and meta-analysis. Iranian Journal of Public Health, 49(7), 1222-1231. https://doi.org/10.18502/ijph.v49i7.3575
-
Aleman, R. S., Moncada, M., & Aryana, K. J. (2023). Leaky gut and the ingredients that help treat it: A review. Molecules, 28(2), 619. https://doi.org/10.3390/molecules28020619.
-
Bischoff, S. C., Barbara, G., Buurman, W., Ockhuizen, T., Schulzke, J.-D., Serino, M., Tilg, H., Watson, A., & Wells, J. M. (2014). Intestinal permeability–a new target for disease prevention and therapy. BMC Gastroenterology, 14(1), 189. https://doi.org/10.1186/s12876-014-0189-7
-
Wan, Y., & Zhang, B. (2022). The impact of zinc and zinc homeostasis on the intestinal mucosal barrier and intestinal diseases. Biomolecules, 12(7), 900. https://doi.org/10.3390/biom12070900
-
Skrovanek, S., DiGuilio, K., Bailey, R., Huntington, W., Urbas, R., Mayilvaganan, B., Mercogliano, G., & Mullin, J. M. (2014). Zinc and gastrointestinal disease. World Journal of Gastrointestinal Pathophysiology, 5(4), 496-513. https://doi.org/10.4291/wjgp.v5.i4.496
-
Maares, M., & Haase, H. (2020). A guide to human zinc absorption: General overview and recent advances of in vitro intestinal models. Nutrients, 12(3), 762. https://doi.org/10.3390/nu12030762
-
Deters, B. J., & Saleem, M. (2021). The role of glutamine in supporting gut health and neuropsychiatric factors. Food Science and Human Wellness, 10(2), 149-154. https://doi.org/10.1016/j.fshw.2021.02.003
-
Peña-Durán, E., García-Galindo, J. J., López-Murillo, L. D., Huerta-Huerta, A., Balleza-Alejandri, L. R., Beltrán-Ramírez, A., Anaya-Ambriz, E. J., & Suárez-Rico, D. O. (2025). Microbiota and inflammatory markers: A review of their interplay, clinical implications, and metabolic disorders. International Journal of Molecular Sciences, 26(4). https://doi.org/10.3390/ijms26041773
-
Martinez, E. E., Lan, J., Konno, T., Miranda-Ribera, A., Fiorentino, M., Mehta, N. M., & Fasano, A. (2021). Novel role of zonulin in the pathophysiology of gastro-duodenal transit: A clinical and translational study. Scientific Reports, 11, 22462. https://doi.org/10.1038/s41598-021-01879-y
-
Yonker, L. M., Gilboa, T., Ogata, A. F., Senussi, Y., Lazarovits, R., Boribong, B. P., Bartsch, Y. C., Loiselle, M., Rivas, M. N., Porritt, R. A., Lima, R., Davis, J. P., Farkas, E. J., Burns, M. D., Young, N., Mahajan, V. S., Hajizadeh, S., Lopez, X. I. H., Kreuzer, J., … Fasano, A. (2021). Multisystem inflammatory syndrome in children is driven by zonulin-dependent loss of gut mucosal barrier. The Journal of Clinical Investigation, 131(14). https://doi.org/10.1172/JCI149633
-
Otani, T., & Furuse, M. (2020). Tight junction structure and function revisited. Trends in Cell Biology, 30(10), 805-817. https://doi.org/10.1016/j.tcb.2020.08.004
-
Stevens, B. R., Goel, R., Seungbum, K., Richards, E. M., Holbert, R. C., Pepine, C. J., & Raizada, M. K. (2018). Increased human intestinal barrier permeability plasma biomarkers zonulin and FABP2 correlated with plasma LPS and altered gut microbiome in anxiety or depression. Gut, 67(8), 1555-1557. https://doi.org/10.1136/gutjnl-2017-314759